Les piles électriques
Principe
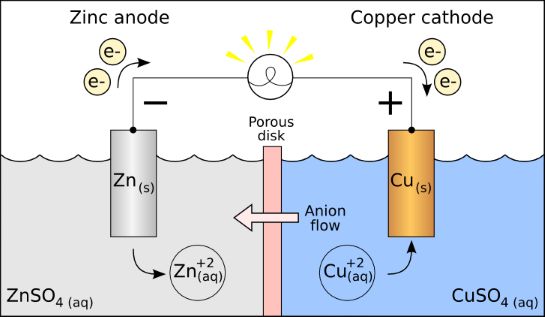
Les piles sont constituées d'une Anode (le zinc par exemple plongé dans une solution de sulfate de zinc ZnSO4) et d'une Cathode (le cuivre par exemple plongé dans une solution de sulfate de cuivre). Les deux composés sont reliés par un "pont salin" conducteur qui permet la circulation des charges électriques.
La réaction d'oxydation d'un atome de zinc entraîne la libération de deux électrons dans le circuit.
Les électrons libérés se dirigent alors vers l'autre électrode de la pile (le pôle +) en créant un courant dans le circuit. Ce courant est conventionnellement positif du pôle + vers le pôle – , alors que les électrons se dirigent du pôle – vers le pôle + (car les électrons sont chargés négativement).
La tension aux bornes de la pile (c’est-à-dire la différence de potentiel entre ses électrodes) est u=E+ - E- approximativement 1,10V.
By Original uploader was Ohiostandard at en.wikipedia - Transferred from en.wikipedia; transferred to Commons by User:Burpelson AFB using CommonsHelper., CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=11236033
Ainsi, chaque élément unitaire d'une pile Zn-Cu posède une tension de 1,1V
Association de piles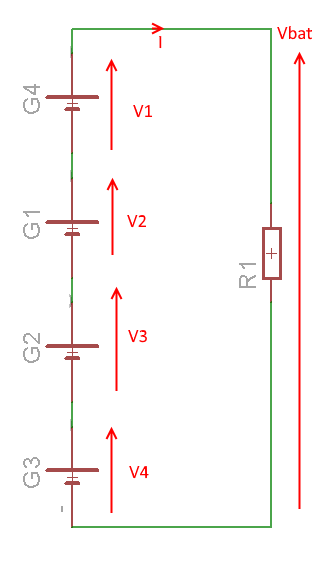
Pour obtenir une tension plus importante aux bornes d'une pile, il est nécessaire d'en mettre plusieurs en série; la loi des mailles s'applique.
Vbat = V1+V2+V3+V4
Chaque cellule a accumulé une charge électrique Q exprimée en Coulomb ou en A.h (Ampère heure). Pour rappel la charge d'un électron est 1,6x10-19C
1Ah = 3600C
L'ampère heure est le produit du temps en heure par le courant débité :
Q= I x t
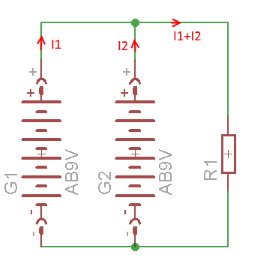 Pour augmenter la capacité à fournir plus de courant, il faut donc augmenter la quantité de charge.
Pour augmenter la capacité à fournir plus de courant, il faut donc augmenter la quantité de charge.
Pour cela une association en série est nécessaire; la loi des noeuds s'applique.
Exemple d'application :
La batterie d'une voiture à une capacité de 50Ah. Elle se recharge en 10 heures.
- Quel est son courant de charge ?
- Quelle est sa charge en Coulomb ?
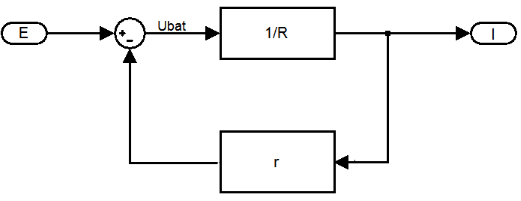
- Le modèle équivalent est donc :
- On peut, à l'aide des blocs fonctionnels, établir un autre modèle :
Q=Ixt donc I = Q/t soit I=50/10 = 5A
50 x 3600 = 180 kC
Pile à combustible
Dans le cas de la pile à combustible la tension est générée grâce à l'oxydation d'un combustible réducteur (Hydrogène) couplée à la réduction d'un oxydant (Oxygène).
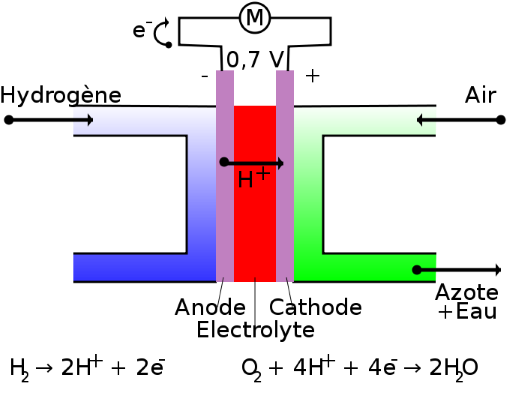
image de HandigeHarry https://commons.wikimedia.org/w/index.php?curid=3923704
Modèles équivalents
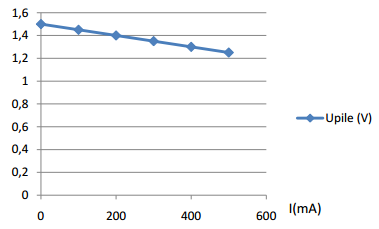 Lorsqu'on relève la tension de la pile en fonction du courant, on remarque que celle diminue presque linéairement.
Lorsqu'on relève la tension de la pile en fonction du courant, on remarque que celle diminue presque linéairement.
Cela s'explique par le fait que la pile possède une résistance interne qui introduit une chute de tension lorsque le courant augmente.
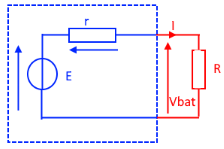
Vbat = E - r x I